Aparte de los antibióticos, existen otras sustancias con propiedades antimicrobianas y con efecto promotor del crecimiento. Este es el caso del óxido de zinc y del cobre, oligoelementos que son añadidos en exceso en las dietas de los cerdos para mejorar la salud intestinal. No obstante, su impacto en la lucha contra la resistencia antimicrobiana no es del todo positiva.
 EL zinc es un oligoelemento esencial para la vida de numerosos organismos. Su efecto positivo en la tasa de crecimiento en la producción porcina ha sido reconocido desde hace mucho tiempo. Una deficiencia de zinc causa reducción del consumo de alimento y del crecimiento, debilitamiento del sistema inmunitario y en casos graves lesiones cutáneas (paraqueratosis). Según el NRC (2012), los requerimientos de zinc en los cerdos están entre 50 y 100 ppm en relación con la edad y el peso del animal. Dado que el contenido de zinc en los ingredientes de los alimentos para animales es bajo, las dietas de los cerdos se suelen suplementar con zinc. En la Unión Europea, el contenido máximo en alimentos para lechones es de 150 ppm. Algunos países han autorizado durante el período posdestete el uso de dosis farmacológicas de zinc (3000 ppm) en premezclas medicadas.
EL zinc es un oligoelemento esencial para la vida de numerosos organismos. Su efecto positivo en la tasa de crecimiento en la producción porcina ha sido reconocido desde hace mucho tiempo. Una deficiencia de zinc causa reducción del consumo de alimento y del crecimiento, debilitamiento del sistema inmunitario y en casos graves lesiones cutáneas (paraqueratosis). Según el NRC (2012), los requerimientos de zinc en los cerdos están entre 50 y 100 ppm en relación con la edad y el peso del animal. Dado que el contenido de zinc en los ingredientes de los alimentos para animales es bajo, las dietas de los cerdos se suelen suplementar con zinc. En la Unión Europea, el contenido máximo en alimentos para lechones es de 150 ppm. Algunos países han autorizado durante el período posdestete el uso de dosis farmacológicas de zinc (3000 ppm) en premezclas medicadas.
Al igual que el zinc, el cobre es un oligoelemento esencial, es un cofactor de numerosas enzimas y un famoso promotor del crecimiento. Una deficiencia puede conducir a problemas físicos como depresión del crecimiento, anemia y malformaciones de las patas. Los requerimientos de cobre en los cerdos son bajos, de 4 a 10 mg de cobre por kg de materia seca en la dieta, solo que a menudo el cobre se suministra en exceso. En la unión europea, los niveles máximos permitidos de cobre en alimentos para lechones hasta las 4 semanas posdestete, son de 150 ppm; para cerdos de hasta las 8 semanas posdestete, de 100 ppm; y para los cerdos mayores, de 25 ppm. Estos oligoelementos se utilizan en niveles altos debido a sus propiedades antimicrobianas.
Como resultado del uso común de antimicrobianos en la producción animal, las bacterias han desarrollado cuatro estrategias principales contra los antibióticos:
- Reducción de la permeabilidad de la membrana (menor expresión de porinas).
- Inactivación del fármaco (producción de enzimas).
- Alteración de las dianas celulares (modificación de los sitios de unión de los antibióticos).
- Eflujo de elementos tóxicos (a través de bombas de eflujo).
 En Dinamarca, la avoparcina (antimicrobiano de tipo glucopéptido), fue utilizado como promotor del crecimiento hasta 1995; ya que, en ese momento, se observó que el 21% del Enterococcus faecium (E. faecium) aislados de las canales de cerdo eran resistente a la avoparcina. Consciente del problema, Dinamarca prohibió el uso no terapéutico de los antibióticos en la producción porcina en los cerdos adultos (1998) y en los lechones (1999). En 2006, la Unión Europea prohibió el uso de los antibióticos utilizados para promover del crecimiento. Hasta nuestros días, el uso de cobre y del zinc han sido una alternativa parcial a los antibióticos para controlar la diarrea asociada al período posdestete en lechones, ya que el cobre y el zinc pueden regular la microflora intestinal. Sin embargo, el exceso de cobre y de zinc también ejercen un impacto negativo en el medio ambiente y en la selección de bacterias resistentes. Se ha podido observar una fuerte correlación entre la resistencia a los metales y la resistencia a los antibióticos.
En Dinamarca, la avoparcina (antimicrobiano de tipo glucopéptido), fue utilizado como promotor del crecimiento hasta 1995; ya que, en ese momento, se observó que el 21% del Enterococcus faecium (E. faecium) aislados de las canales de cerdo eran resistente a la avoparcina. Consciente del problema, Dinamarca prohibió el uso no terapéutico de los antibióticos en la producción porcina en los cerdos adultos (1998) y en los lechones (1999). En 2006, la Unión Europea prohibió el uso de los antibióticos utilizados para promover del crecimiento. Hasta nuestros días, el uso de cobre y del zinc han sido una alternativa parcial a los antibióticos para controlar la diarrea asociada al período posdestete en lechones, ya que el cobre y el zinc pueden regular la microflora intestinal. Sin embargo, el exceso de cobre y de zinc también ejercen un impacto negativo en el medio ambiente y en la selección de bacterias resistentes. Se ha podido observar una fuerte correlación entre la resistencia a los metales y la resistencia a los antibióticos.
Las multirresistencias pueden explicarse por un mecanismo de resistencia cruzada, ya que un solo determinante genético conduce a la resistencia a varios elementos (metales y/o antibióticos). Por ejemplo, las bacterias pueden sintetizar proteínas de transporte para antibióticos y metales. En los microorganismos resistentes al zinc, las bombas de eflujo reducen el zinc intracelular desde la célula; estas bombas pueden ser específicas para el zinc o pueden aceptar otras moléculas. Por consiguiente, las bacterias resistentes al zinc también pueden ser resistentes a uno o más antibióticos.
La multirresistencia también puede estar asociada a la corresistencia, o que diferentes genes de resistencia están presentes en el mismo elemento genético, en general en un elemento móvil como un plásmido. Algunas asociaciones metal-antibióticos están estudiadas en la literatura: por ejemplo, la resistencia al zinc ligada a la resistencia a la meticilina en Staphylococcus aureus (S. aureus), o la resistencia al cobre ligada a las resistencias a macrólidos y glucopéptidos en E. faecium
El gen denominado “czrC” confiere resistencia al cadmio y al zinc en S. aureus. Un estudio con cerdos en diferentes países demostró que, el gen czrC estaba presente en el 95 % de los aislamientos resistentes al zinc en estos animales. Y que menos del 1% de los aislamientos que involucran a crzC eran sensibles al zinc. Se observó una fuerte correlación entre la resistencia al zinc y la resistencia a la meticilina: en los aislamientos sensibles a la meticilina, todos eran sensibles al cloruro de zinc; y en los aislamientos resistentes a la meticilina, más del 90% eran resistentes al cloruro de zinc.
De manera contraria, en otro estudio en Dinamarca se encontró que ninguno de los aislamientos de cerdos sensibles a la meticilina y resistentes a la meticilina (74%), eran resistentes al zinc. Se ha estimado que la concentración mínima inhibitoria (CMI) promedio del zinc para las bacterias resistentes, es 4 veces mayor que la CIM normal: 8 mM de Zn para el S. aureus resistente a la meticilina (SARM) frente a 2 mM de Zn para el S. aureus sensible a la meticilina (SASM). En una palabra, seleccionar bacterias resistentes al zinc significa seleccionar bacterias resistentes a los antibióticos (Figura 1).
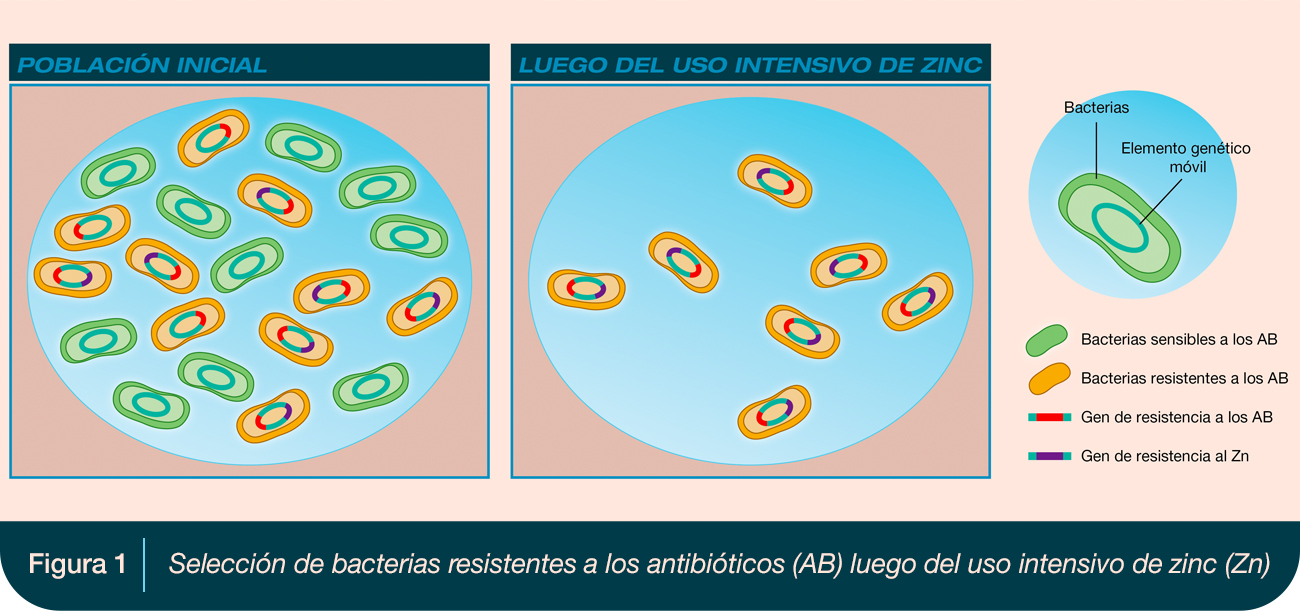
En Europa, Canadá y EE. UU. (Medio Oeste), una emergencia de SARM con un perfil genético similar (complejo clonal 398), se vio facilitado por el uso de tetraciclina y de óxido de zinc. Recientemente, esta cepa también se ha encontrado en Australia y Nueva Zelanda. Se realizaron experimentos de colonización nasal con SARM en cerdos, observándose mayores recuentos de SARM en cerdos tratados con zinc o tetraciclina. La propagación de las bacterias resistentes fue rápida: luego de tres semanas, todos los animales negativos para SARM alojados con animales positivos para SARM se volvieron positivos.
Un fenómeno similar se observa con el cobre, o de poder ejercer una presión coselectiva en favor de las bacterias resistentes a macrólidos y glucopéptidos. La resistencia transferible adquirida al cobre en general se observa en bacterias Gram negativas, raramente en bacterias Gram positivas. Y está ligada al gen tcrB, resistencia transferible al cobre homólogo a copB. Un estudio con aislamientos de E. faecium de Dinamarca, sugirió que la presencia de este gen se correlaciona directamente con el nivel de cobre en la dieta. La resistencia al cobre fue habitual en aislamientos de cerdos (45 /59 aislamientos), común en aislamientos de aves (10/29) y poco frecuente en aislamientos de terneros (5/32), ovejas (0/22) y humanos (3/29). La mayor frecuencia de aislamientos resistentes en los cerdos podría explicarse por la mayor suplementación del cobre en esta especie. Además, más de la mitad de los aislamientos de cerdos fueron resistentes a los macrólidos y casi una cuarta parte a los glucopéptidos.
En este estudio, todas las cepas resistentes a los glucopéptidos fueron resistentes a los macrólidos y al cobre; y todas las resistentes a los macrólidos fueron resistentes al cobre; solo 4 aislamientos resistentes al cobre fueron sensibles a los antibióticos (menos del 10 % de este grupo). De los aislamientos de cerdos, los genes responsables de la resistencia al cobre, el tcrB y el responsable de la resistencia a los macrólidos, el erm(B), podrían estar localizados en el mismo plásmido; y el gen de resistencia a los glucopéptidos también estaría físicamente vinculado al gen tcrB.
Dado que el estiércol de cerdo puede utilizarse como fertilizante, las bacterias resistentes a los antibióticos pueden propagarse en los suelos. Un estudio mostró una correlación entre resistencias a los antibióticos y resistencia al cobre en microorganismos del suelo: por ejemplo, la incidencia de resistencia a la ampicilina fue significativamente mayor en las bacterias resistentes al cobre que en las bacterias sensibles al cobre. Además, la frecuencia de resistencias múltiples en bacterias resistentes al cobre es más del doble que en bacterias sensibles al cobre.
Las cepas resistentes podrían propagarse rápidamente en el animal y entre los animales y en el ambiente. Generación tras generación, los antibióticos se vuelven cada vez menos efectivos cuando el zinc o el cobre seleccionan cepas resistentes, las transferencias horizontales están involucradas en este fenómeno.Las bacterias sensibles pueden volverse resistentes al contacto con bacterias resistentes ya que los intercambios genéticos son posibles entre los microorganismos. Los genes de resistencia suelen estar localizados en elementos genéticos móviles (plásmidos, transposones), lo que facilita la transferencia horizontal. Las bacterias pueden ser capaces de aceptar plásmidos o transposones de otras células, mediante apareamiento (conjugación); y también podrían incorporar material genético exógeno en su propio genoma (transformación). En los casos específicos, el ADN puede transferirse de una bacteria resistente a otra mediante un fago (transducción). Luego, las bacterias que se vuelven resistentes pueden transferir sus genes a células hijas durante la división celular. Por consiguiente, el uso de zinc o cobre en exceso crea una nueva generación de bacterias resistentes a metales y antibióticos.
Para combatir la resistencia a los antibióticos en la producción porcina se requiere: una reducción del uso de antibióticos y un mejor uso del zinc y el cobre suplementados en las dietas de los cerdos.
Crédito: Enlace fuente






